Un jove, molt greu en ser atropellat a la carretera entre Lloseta i Inca
Ha estat conduït a Son Espases, en comptes de l'hospital d'Inca, a causa del seu estat




Es reclutaran 30.000 voluntaris de vuit països per estudiar la seguretat i l'eficàcia de les dosis
 85
85
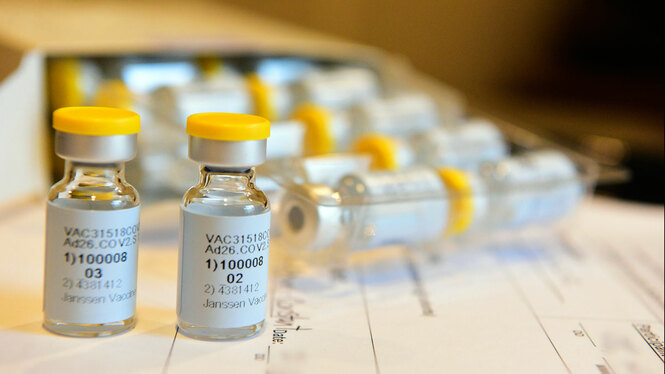
L’Agència Espanyola de Medicaments i Productes Sanitaris (AEMPS) ha autoritzat el primer assaig clínic fase III per a la vacuna contra la covid-19 de la companyia Janssen, pertanyent a la multinacional Johnson&Johnson, ha informat el Ministeri de Sanitat.
Es tracta del primer assaig en fase III d’aquest tipus autoritzat a Espanya, en el qual s’avaluarà l’eficàcia i seguretat d’aquesta vacuna que també es provarà en altres vuit països, per al que es reclutarà a uns 30.000 voluntaris.
A Espanya, l’assaig constarà de dues dosis de vacuna i es durà a terme en nou centres hospitalaris que iniciaran, tan aviat com sigui possible, el reclutament de voluntaris que compleixin amb els criteris d’inclusió especificats en el seu protocol.
A més d’Espanya, els països participants són: Bèlgica, Colòmbia, França, Alemanya, Filipines, Sud-àfrica, Regne Unit i els Estats Units.
En l’estudi es vacunarà inicialment a participants sense malalties concomitants que s’associen a un major risc de progressió a covid-19 greu.
Segons ha informat Sanitat, es tracta d’un assaig multinacional (en el qual s’administra la vacuna o un placebo emmascarat de manera que s’impedeixi la seva identificació a simple vista) que estudiarà la seguretat i eficàcia d’un règim de dues dosis.
Després de l’avaluació per part d’un comitè independent de vigilància de les dades de seguretat d’aquests participants, es passarà eventualment a incloure a participants amb malalties que sí que s’associen a un major risc de progressió a covid greu, ha informat Sanitat.
Un 20% dels pacients seran menors de 40 anys, i un 30% majors de 60 anys.
Durant tot assaig es durà a terme un monitoratge estret de tots els voluntaris i una identificació de tots els casos.
El Ministeri ha recordat que “només després de l’anàlisi de les dades per les autoritats reguladores competents, i una avaluació favorable del balanç benefici-risc, s’autoritzaria la comercialització en territori europeu”.
Aquests assajos clínics formen part dels requeriments que han de dur a terme totes les vacunes per demostrar la seva qualitat, seguretat i eficàcia.
El Ministeri de Sanitat, a través de la AEMPS, manté contacte amb diferents companyies que han proposat la inclusió de centres espanyols en els seus assajos clínics per a contribuir a l’esforç global en la cerca de la vacuna contra la covid-19.
Ha estat conduït a Son Espases, en comptes de l'hospital d'Inca, a causa del seu estat

L’home, d’una quarantena d’anys i de nacionalitat estrangera, ha estat atropellat per dues furgonetes a la via que connecta Santa Maria del Camí amb Santa Eugènia

Ha estat trobada aquest divendres al matí en la casa d'una finca d’un veïnat

Un particular restaura el llaüt 'Els Gorretes', que sortí de drassanes l'any 1891, a Maó, i des de llavors sempre ha mantengut l'activitat
